|
| Foro Departamento de Química Teóricos Química orgánica |
| Química orgánica |
|
12-03-2013, 7:15 PM
Post: #1
|
|||
|
|||
|
La química orgánica trata de los compuestos del carbono. Más del 90% de todos los compuestos conocidos contienen átomos de carbono. Esto se debe a que los átomos del carbono se unen entre sí en un grado mucho mayor que los átomos de cualquier otro elemento. Los átomos de carbono pueden unirse para formar cadenas o anillos.
Tipos de enlace: · Sencillos (un par de electrones) · Dobles (dos pares de electrones) · Triples (tres pares de electrones) Características comunes: 1. Los compuestos orgánicos son en general moleculares en lugar de iónicos. 2. Cada átomo de carbono forma un total de cuatro enlaces covalentes: pudiendo formar cuatro enlaces sencillos, dos enlaces sencillos y un enlace doble, dos enlaces dobles o un enlace sencillo y un enlace triple. 3. Los átomos de carbono pueden unirse entre sí o a tros átomos de no-metales, muy frecuentemente a hidrógeno, un halógeno, oxígeno o nitrogeno. 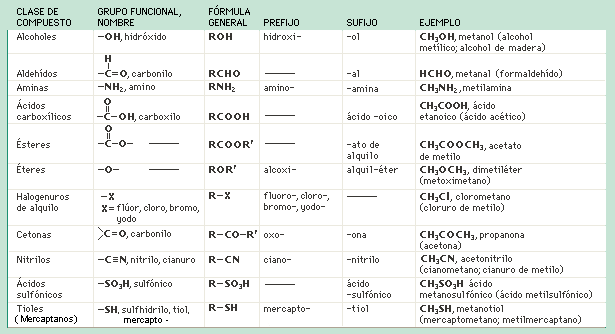 ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
|
12-03-2013, 7:21 PM
Post: #2
|
|||
|
|||
|
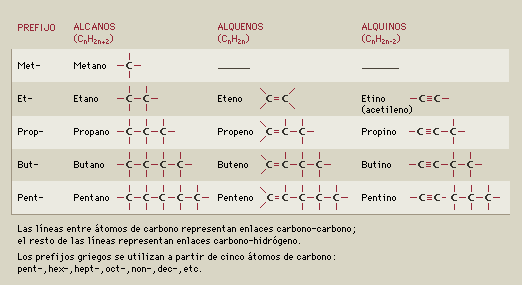
Hidrocarburos saturados o alcanos:
Son aquellas sustancias en las que todos los enlaces carbono-carbono son enlaces sencillos. Se conocen como saturados debido a que la razón entre átomos de hidrógeno y de carbono es máxima. Fórmula general: $$ C_{n}H_{2·n+2} $$ \( n \) = cantidad de átomos Los compuestos que tienen las mismas fórmulas moleculares pero diferentes estructuras moleculares se denomina isómeros estructurales. En general, los isómeros muy "alargados", tienden a tener puntos de ebullición más altos que los isómeros altamente ramificados. Las fuerzas de dispersión se hacen más débiles al aumentar la ramificación de cadena. Nomenclatura: Se llama a los alcanos de cadena lineal con el prefijo que indica el número de carbonos y la terminación ano. Para nombrar alcanos ramificados, se ha adoptado que se compone de dos partes: la cadena principal y la o las ramificaciones. Quote La cadena principal es la que tiene mayor número de C, es la más larga y contiene al grupo funcional. La ramificación la consideramos por separado de la cadena principal; cada radical puede considerarse generado a partir de cada hidrocarburo, por supresión de un hidrógeno, y recibe el nombre de hidrocarburo del que procede, cambiando su terminación ano en ilo; por eso se los llama también radicales alquilo.  Se debe nombrar primero la ramificación o sustituyente, anteponiendo el número que indica en qué posición de la cadena principal se encuentra. Al final va el nombre de la cadena principal. ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
|
12-03-2013, 7:32 PM
Post: #3
|
|||
|
|||
|
Hidrocarburos insaturados: alquenos y alquinos
En un hidrocarburo insaturado, al menos uno de los enlaces carbono-carbono de la molécula es un enlace múltiple. Alquenos: En los que hay un enlace doble carbono-carbono en la molécula. Fórmula general: $$ C_{n}H_{2} $$ \( n \) = cantidad de átomos Alquinos: En los que hay un enlace triple carbono-carbono en la molécula. Fórmula general: $$ C_{n}H_{2·n-2} $$ \( n \) = cantidad de átomos ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
|
10-05-2013, 9:28 PM
Post: #4
|
|||
|
|||
 ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
|
23-12-2014, 4:39 PM
Post: #5
|
|||
|
|||
|
Hola me parece un excelente post, para tener en cuenta.
Saludos!!!! |
|||
| |||
| |||
| Últimos cinco temas activos... | |||||
| Tema | Foro | Autor | Respuestas | Último mensaje | |
 | PENDIENTE Ejercicios sobre la ley de Snell (refracción) | Problemas sin resolver | marcos364 | 3 | 19-11-2019 3:52 AM Último mensaje: jaztallica |
 | Saludos a todos | Presentaciones | JOHN | 2 | 29-11-2017 10:20 PM Último mensaje: brunoosorioalmanzar |
 | PENDIENTE Ecuacion circunferencias | Problemas sin resolver | elva | 1 | 08-03-2016 2:06 AM Último mensaje: Admin |
 | Geometría analítica en el plano: circunferencia | Teóricos | Admin | 4 | 18-11-2015 10:57 PM Último mensaje: joserodriguez0173 |
 | PENDIENTE Problema de dinamica, cañón unido a resorte | Problemas sin resolver | andremn | 1 | 14-11-2015 3:18 PM Último mensaje: jotazone10 |







