|
| Foro Departamento de Química Teóricos Estado líquido |
| Estado líquido |
|
31-01-2013, 12:37 PM
Post: #1
|
|||
|
|||
|
Evaporación:
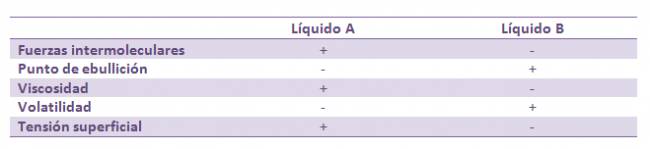
Si tenemos un líquido en un recipiente y en un sistema cerrado, primero que se observará que el nivel de líquido desciende progresivamente por el fenómeno de evaporación, pero llega un momento en que el nivel del líquido permanece constante. La evaporación no cesa, sino que se ha alcanzado un equilibrio dinámico: el número de moléculas que retornar de la fase gaseoso a la fase líquida compensa al número de moléculas que de la fase líquida escapan a la fase gaseosa. Presión de vapor de un líquido en equilibrio: Es la presión ejercida por la fase de vapor de una sustancia en equilibrio con su fase líquida a una temperatura dada. Factores: a. Naturaleza del líquido: líquido con fuerzas intermoleculares débiles (ej.: London) las moléculas presentan tendencia a escapar a la fase de vapor (líquido volátil), por lo que el líquido tendrá presión de vapor alta. Líquido con fuerzas intermoleculares intensas: Las moléculas presentan escasa tendencia a escapar a la fase de vapor por lo que la presión de vapor será baja. b. Temperatura: si aumenta la temperatura, aumenta la energía cinético-molecular debilitándose las fuerzas de atracción intermoleculares, las moléculas tienen mayor facilidad para escapar a la fase de vapor y con ello la presión de vapor aumenta. Si la temperatura disminuye ocurre lo contrario. Evaporación: Recordar que para que una molécula escape de la fase líquida a la fase de vapor debe cumplir dos condiciones: a. Estar en la superficie o próxima a ella. b. Poseer energía cinética suficiente. En la ebullición la formación de burbujas aumenta la extensión de la superficie límite, por lo que no importa dónde está situada una molécula del líquido, alcanza con que tenga la energía cinética suficiente. Cuando un líquido hierve, la temperatura permanece constate porque todo el calor suministrado es empleado por las moléculas para escapar a la fase de vapor por lo que la energía cinética media del líquido no varía. Punto de ebullición: Es la temperatura a la cual la presión de vapor de un líquido iguala a la presión externa. El punto de ebullición de un líquido depende de la presión externa a la que está expuesto. Presión atmosférica disminuye, punto de ebullición disminuye. Punto de ebullición normal: Es la temperatura a la cual la presión de vapor de un líquido iguala a ala presión atmosférica normal (760 torr ó 760 mm de Hg ó 1 atm) Viscosidad: Es la resistencia que pone un líquido a fluir libremente. Factores: a. Naturaleza del líquido: cuanto más intensas sean las fuerzas de atracción intermoleculares, más viscoso será el líquido. b. Temperatura: si la temperatura aumenta, aumenta la energía cinético-molecular, las fuerzas atractivas se debilitan y la viscosidad disminuye. Tensión superficial: Si consideramos una molécula en el interior del líquido, veremos que ésta es atraída por las moléculas que están a sus lados, por arriba y por debajo de ella. En cambio una molécula en la superficie será atraída por las moléculas que están a sus lados y fundamentalmente por debajo de ella. 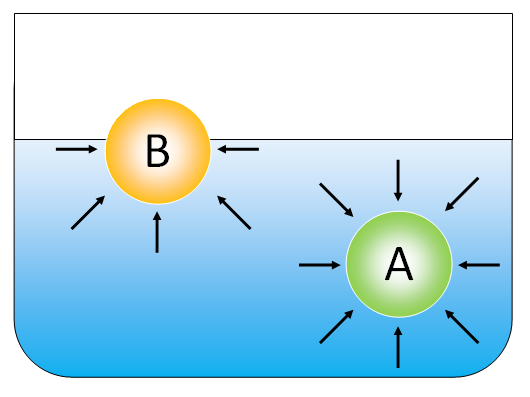 Todas las moléculas que se encuentran en la superficie, sufren globalmente una fuerza atractiva hacia el interior del líquido que se manifiesta como una fuerza o tensión especial del líquido que se resiste a ser perturbado por la penetración (por eso algunos insectos caminan sobre el agua, si el peso de sus cuerpos es inferior a la tensión superficial), por la misma razón los líquidos tienden a minimizar el área superficial, por eso una gota de un líquido tiende a ser esférica. Factores: a. Naturaleza del líquido: cuanto más intensas sean las fuerzas intermoleculares, mayor será la tensión superficial. b. Temperatura: si la temperatura aumenta, las fuerzas atractivas se debilitan y la tensión superficial disminuye. La tensión superficial de los líquidos se manifiesta en fenómenos como la mojabilidad de los sólidos por los líquidos, la elevación capilar de los líquidos en tubos delgados y la curvatura de la superficie de los líquidos. Capilaridad: El agua puede mojar ciertos materiales, por ejemplo: · Prendas de algodón (celulosa). · Componentes del suelo (arcillas). · Vidrios, etc. Explicación: Las moléculas de agua forman puentes de hidrógeno con los átomos de oxígeno de los materiales mencionados. Los líquidos en su mayoría (excepto Hg) forman meniscos cóncavos hacia arriba, esto se debe a la tensión superficial y a las fuerzas atractivas que se establecen entre las moléculas de agua y la superficie del vidrio. En los bordes, el agua parece trepar debido a que las moléculas de agua en ese punto forman puentes de hidrógeno con los átomos de oxígeno del vidrio. Definimos como acción capilar o capilaridad, al movimiento de los líquidos por los tubos capilares como resultado de la tensión superficial, siendo un fenómeno de gran importancia biológica. Ejemplo: · Circulación de agua en los suelos. · Circulación de gua en las raíces y tallos, en las plantas. · Circulación de gua en la sangre de los seres vivos. Diferencias notables entre los fenómenos evaporación y ebullición: ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
| |||
| |||
| Últimos cinco temas activos... | |||||
| Tema | Foro | Autor | Respuestas | Último mensaje | |
 | PENDIENTE Ejercicios sobre la ley de Snell (refracción) | Problemas sin resolver | marcos364 | 3 | 19-11-2019 3:52 AM Último mensaje: jaztallica |
 | Saludos a todos | Presentaciones | JOHN | 2 | 29-11-2017 10:20 PM Último mensaje: brunoosorioalmanzar |
 | PENDIENTE Ecuacion circunferencias | Problemas sin resolver | elva | 1 | 08-03-2016 2:06 AM Último mensaje: Admin |
 | Geometría analítica en el plano: circunferencia | Teóricos | Admin | 4 | 18-11-2015 10:57 PM Último mensaje: joserodriguez0173 |
 | PENDIENTE Problema de dinamica, cañón unido a resorte | Problemas sin resolver | andremn | 1 | 14-11-2015 3:18 PM Último mensaje: jotazone10 |