|
| Foro Departamento de Química Teóricos Soluciones |
| Soluciones |
|
23-10-2012, 5:34 PM
Post: #1
|
|||
|
|||
|
Solución: sistema homogéneo constituido por dos o más componentes.
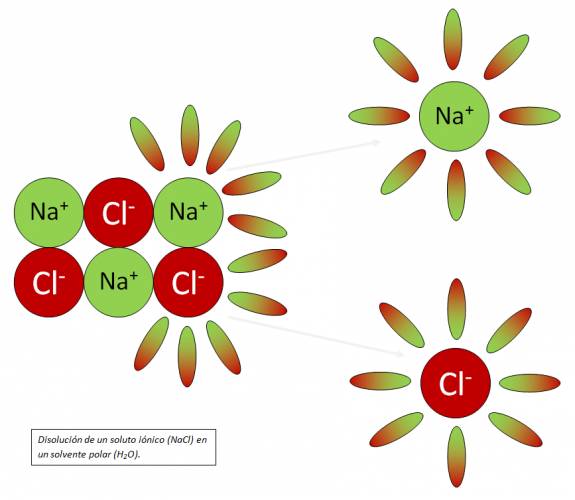
Soluto: componente de la solución que se encuentra en menor cantidad. Solvente: componente de la solución que se encuentra en mayor cantidad; si uno de los componentes de la solución es agua, ésta será siempre el solvente, aunque se encuentre en menor cantidad. Quote Según el estado de agregación de soluto y solvente, existen nueve tipos de posibles de combinaciones:  Amalgama: aleación en la cual el Hg (mercurio) está en estado líquido. Para indicar cualitativamente las cantidades relativas de los componentes de una solución: · Diluida: cantidad de soluto pequeña respecto a la de solvente. · Concentrada: cantidad de soluto es apreciable respecto a la de solvente. · Saturada: es aquella que está en equilibrio con parte del soluto sin disolver. · Insaturada: contiene menor cantidad de soluto que la que produce la saturación. · Sobresaturada: solución inestable en la que existe una cantidad de soluto mayor que la de saturación. Proceso de disolución: Si dos sustancias presentan fuerzas de atracción intermoleculares semejantes, muy probablemente sean solubles entre sí. Quote "Lo semejante disuelve a lo semejante" En general: sustancias polares se disuelven en solventes polares; sustancias no polares se disuelven en solventes no polares; muchas sustancias iónicas pueden disolverse en solventes polares. En el proceso de disolución: 1. Las partículas de soluto se separan unas de otras (proceso endotérmico). 2. Las partículas de solvente se separan unas de otras, para dejar huecos donde se distribuyen las partículas de soluto (proceso endotérmico). 3. Las partículas de soluto y solvente se atraen mutuamente (proceso exotérmico). Calor de disolución: Es el calor desprendido o absorbido en el proceso en el cual el soluto se disuelve en un solvente. Dependiendo del soluto y del solvente involucrado (naturaleza), la disolución puede ser endotérmica o exotérmica. En general, el proceso de disolución global consta de dos fases: 1. Ruptura de enlaces químicos o fuerzas de atracción soluto-solvente y solvente-soluto (proceso endotérmico). 2. Formación de nuevas atracciones intermoleculares soluto-solvente (proceso exotérmico). 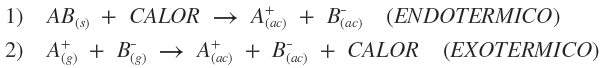  Solubilidad: La disolución de un soluto dado en un solvente determinado depende de tres factores: 1. Naturaleza de soluto y solvente, y las interacciones que se dan entre las partículas de ambos. 2. Temperatura. 3. Presión (para solutos gaseosos). Temperatura: teniendo en cuenta que un aumento de temperatura favorece el proceso endotérmico, al desplazar la posición de equilibrio, puede ocurrir que: a. Si el proceso global es endotérmico, al aumentar la temperatura se incrementa la solubilidad. b. Si el proceso global es exotérmico, al aumentar la temperatura, la solubilidad disminuye. Como la mayoría de los procesos de disolución son endotérmicos, por lo general la solubilidad de los solutos sólidos aumenta con la temperatura. Para el caso de solutos gaseosos en solventes líquidos, el proceso de disolución es siempre exotérmico, por lo que un aumento de temperatura determinará una menor solubilidad, la cual será si la temperatura disminuye. Presión: para solutos gaseosos en solventes líquidos, a temperatura constante, un aumento de la presión incrementa la solubilidad y ésta disminuye al descender la presión. Ley de Henry: al aumentar la presión, aumenta la concentración de moléculas en fase gaseosa, por lo que, para compensar el cambio y mantener el equilibrio, un mayor número de moléculas de gas pasan a la solución, aumentando su concentración en la fase líquida. Unidades de concentración de soluciones Concentración: relación cuantitativa entre la cantidad de soluto y la cantidad de solvente o solución.  Preparación de una solución: · Por pesada directa: "Se pesan ______ gramos de ______ y se completa con H2O destilada hasta ______ mL de solución." · Por dilución: "Se mide con pipeta ______ mL de solución de ______ y se completa con H2O destilada hasta ______ mL de solución." ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
|
02-05-2013, 1:20 AM
Post: #2
|
|||
|
|||
|
· Emulsión: es una mezcla de líquidos inmiscibles de manera más o menos homogénea.
· Precipitado: es aquella parte del soluto que no se disuelve en la solución. ¿No estás de acuerdo con lo que escribí? ¡por favor explícame tu punto de vista! :) · No se resuelven problemas ni se responde a consultas sobre matemática, física ni química por mensaje privado. · Si utilizas material de este sitio, no olvides citar la fuente. · Si te sirvió lo que dije, puedes agradecerme aumentado mi reputación. · Si ven que tengo una falta de ortografía un hechicero lo hizo. |
|||
| |||
| |||
| Últimos cinco temas activos... | |||||
| Tema | Foro | Autor | Respuestas | Último mensaje | |
 | PENDIENTE Ejercicios sobre la ley de Snell (refracción) | Problemas sin resolver | marcos364 | 3 | 19-11-2019 3:52 AM Último mensaje: jaztallica |
 | Saludos a todos | Presentaciones | JOHN | 2 | 29-11-2017 10:20 PM Último mensaje: brunoosorioalmanzar |
 | PENDIENTE Ecuacion circunferencias | Problemas sin resolver | elva | 1 | 08-03-2016 2:06 AM Último mensaje: Admin |
 | Geometría analítica en el plano: circunferencia | Teóricos | Admin | 4 | 18-11-2015 10:57 PM Último mensaje: joserodriguez0173 |
 | PENDIENTE Problema de dinamica, cañón unido a resorte | Problemas sin resolver | andremn | 1 | 14-11-2015 3:18 PM Último mensaje: jotazone10 |