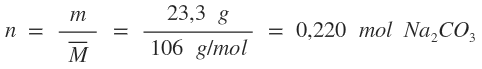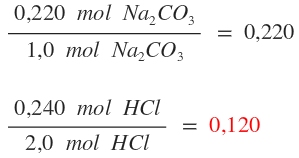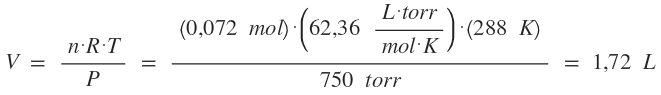06-10-2012, 3:58 PM
1. ¿Cuántos gramos de CaO sólido se necesitan para reaccionar con 50,0 mL de HCl 0,60 M, según la ecuación:
CaO + HCl ⇌ CaCl2 + H2O
2. Dada la reacción:
Na2CO3 + HCl ⇌ CO2 + NaCl + H2O
Se colocan a reaccionar en un recipiente 23,3 g de carbonato de sodio y 120 mL de HCl 2,00 M.
a. Iguale la ecuación.
b. Determina cuál es el reactivo limitante.
c. Determina el porcentaje de rendimiento, sabiendo que experimentalmente se obtuvieron 0,0720 mol de CO2.
d. ¿Qué volumen representan los moles de CO2 recogidos a 750 torr y 15ºC?
CaO + HCl ⇌ CaCl2 + H2O
2. Dada la reacción:
Na2CO3 + HCl ⇌ CO2 + NaCl + H2O
Se colocan a reaccionar en un recipiente 23,3 g de carbonato de sodio y 120 mL de HCl 2,00 M.
a. Iguale la ecuación.
b. Determina cuál es el reactivo limitante.
c. Determina el porcentaje de rendimiento, sabiendo que experimentalmente se obtuvieron 0,0720 mol de CO2.
d. ¿Qué volumen representan los moles de CO2 recogidos a 750 torr y 15ºC?