01-11-2012, 7:35 PM
Estado sólido
· Sólidos amorfos:
Son aquellos que no presentan una forma regular y ordenada, se obtienen mediante el enfriamiento brúsco de un líquido. En este caso las partículas no logran un ordenameinto.
Ejemplos: vidrio, plásticos, hule.
· Sólidos cristalinos:
Se obtienen mediante enfriamiento progresivo. Esto permite que las partículas puedan adquirrir una disposición ordenada en el espacio.
Determinar tipo de cristal por electronegatividad:
· Si 0,0 < ∆EN < 0,5 → cristales moleculares (moléculas apolares).
· Si 0,6 < ∆EN < 1,6 → cristales moleculares (moléculas polares).
· Si 1,7 < ∆EN → cristales iónicos.
Punto de fusión:
· Si se trata de dos sólidos cristalinos del mismo tipo, tendrá mayor punto de fusión el que posea mayor ∆EN.
· Cuando dos sólidos cristalinos del mismo tipo y la misma ∆EN, tendrá punto de fusión más alto el que esté constituido por partículas más grandes.
Punto de fusión con respecto al tipo de cristal:
Covalente > Iónico > Metálico > Molecular
· Sólidos amorfos:
Son aquellos que no presentan una forma regular y ordenada, se obtienen mediante el enfriamiento brúsco de un líquido. En este caso las partículas no logran un ordenameinto.
Ejemplos: vidrio, plásticos, hule.
· Sólidos cristalinos:
Se obtienen mediante enfriamiento progresivo. Esto permite que las partículas puedan adquirrir una disposición ordenada en el espacio.
Quote
Cristal: disposición espacial de las partículas de un sólido (átomos, moléculas o iones) en un modelo tridimensional repetitivo.
Quote
A tener en cuenta:
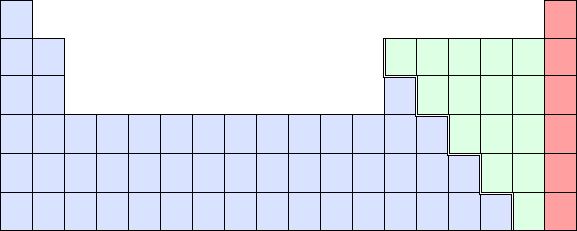
1. Si se trata de una sustancia simple en estado atómico, y respecto a la tabla periódica de arriba:
· azul = forman generalmente cristales metálicos (excepto C, Al, Fe, S, Ge, entre otros).
· verde = forman cristales covalentes.
· rojo = forman cristales moleculares.
2. Si se trata de una sustancia simple en estado molecular, en este caso, los cristales serán siempre moleculares, formados por moléculas apolares. Ejemplo: O2, Br2, N2, P4.
3. Si se trata de una sustancia compuesta (formada por átomos de diferentes especies) debemos hallar diferencia de electronegatividad.
4. Si se trata de un compuesto ternario (formado por tres elementos) no se puede hacer ∆EN.
5. Si el nombre del compuesto termina en -ato, -ito es iónico (debido a que las sales siempre son iónicas).

1. Si se trata de una sustancia simple en estado atómico, y respecto a la tabla periódica de arriba:
· azul = forman generalmente cristales metálicos (excepto C, Al, Fe, S, Ge, entre otros).
· verde = forman cristales covalentes.
· rojo = forman cristales moleculares.
2. Si se trata de una sustancia simple en estado molecular, en este caso, los cristales serán siempre moleculares, formados por moléculas apolares. Ejemplo: O2, Br2, N2, P4.
3. Si se trata de una sustancia compuesta (formada por átomos de diferentes especies) debemos hallar diferencia de electronegatividad.
4. Si se trata de un compuesto ternario (formado por tres elementos) no se puede hacer ∆EN.
5. Si el nombre del compuesto termina en -ato, -ito es iónico (debido a que las sales siempre son iónicas).
Determinar tipo de cristal por electronegatividad:
· Si 0,0 < ∆EN < 0,5 → cristales moleculares (moléculas apolares).
· Si 0,6 < ∆EN < 1,6 → cristales moleculares (moléculas polares).
· Si 1,7 < ∆EN → cristales iónicos.
Punto de fusión:
· Si se trata de dos sólidos cristalinos del mismo tipo, tendrá mayor punto de fusión el que posea mayor ∆EN.
· Cuando dos sólidos cristalinos del mismo tipo y la misma ∆EN, tendrá punto de fusión más alto el que esté constituido por partículas más grandes.
Punto de fusión con respecto al tipo de cristal:
Covalente > Iónico > Metálico > Molecular