09-09-2013, 1:59 AM
Potencial de Hidrógeno
El pH de una solución, es un número que determina si ésta es ácida, básica o neutra.
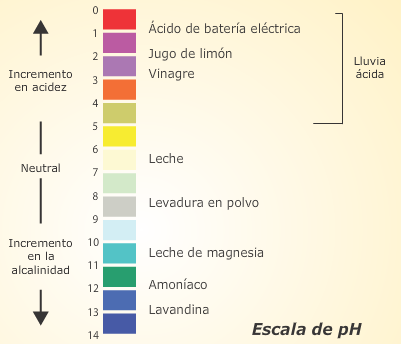
El rango que abarca el pH es desde 0 hasta 14. Cuanto menor sea el pH, más ácida será la solución; cuanto mayor sea el pH, menos ácida (más básica) será la solución. Por convención se dice que \( pH = 7 \) es neutro.
Tabla de pH:
Cómo calcular el pH de una solución:
· Si se tiene un ácido se hallará el pH.
· Si se tiene una base el pOH (pH = 14 - pOH).
· Si se trata de ácidos (por ejemplo, el ácido clorhídrico: HCl) o bases (por ejemplo, el hidróxido de sodio: NaOH) fuertes, la concentración de equilibrio es igual a la inicial porque se halla totalmente disociada.
· Si se tuviera un ácido o base débil la concentración de equilibrio es:
$$ \sqrt{Ci·Ka} \mbox{ ó } \sqrt{Ci·Kb} $$
Notación:
· \( Ka \) = constante ácida (es adimensional).
· \( Kb \) = constante básica (es adimensional).
Se debe recordar en todos los casos que la concentración debe expresarse en molaridad.
En química, cuando se habla, por ejemplo, de \( pKa \), se está hablando matemática de: \( -\ln (Ka) \), siendo \( Ka \) una constante.
Cómo saber si se trata de un ácido o una base débil o fuerte:
· Si se nos da la constante de basicidad o acidez, es porque necesariamente se trata de una base o ácido débil, respectivamente.
· Todos los ácidos inorgánicos son débiles.
El pH de una solución, es un número que determina si ésta es ácida, básica o neutra.
El rango que abarca el pH es desde 0 hasta 14. Cuanto menor sea el pH, más ácida será la solución; cuanto mayor sea el pH, menos ácida (más básica) será la solución. Por convención se dice que \( pH = 7 \) es neutro.
Tabla de pH:

Cómo calcular el pH de una solución:
· Si se tiene un ácido se hallará el pH.
· Si se tiene una base el pOH (pH = 14 - pOH).
· Si se trata de ácidos (por ejemplo, el ácido clorhídrico: HCl) o bases (por ejemplo, el hidróxido de sodio: NaOH) fuertes, la concentración de equilibrio es igual a la inicial porque se halla totalmente disociada.
· Si se tuviera un ácido o base débil la concentración de equilibrio es:
$$ \sqrt{Ci·Ka} \mbox{ ó } \sqrt{Ci·Kb} $$
Notación:
· \( Ka \) = constante ácida (es adimensional).
· \( Kb \) = constante básica (es adimensional).
Se debe recordar en todos los casos que la concentración debe expresarse en molaridad.
En química, cuando se habla, por ejemplo, de \( pKa \), se está hablando matemática de: \( -\ln (Ka) \), siendo \( Ka \) una constante.
Cómo saber si se trata de un ácido o una base débil o fuerte:
· Si se nos da la constante de basicidad o acidez, es porque necesariamente se trata de una base o ácido débil, respectivamente.
· Todos los ácidos inorgánicos son débiles.