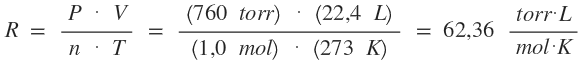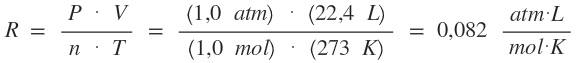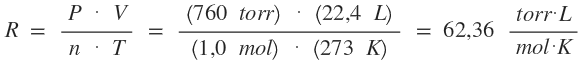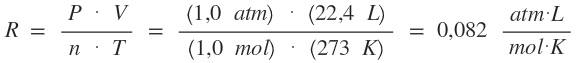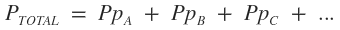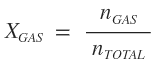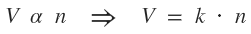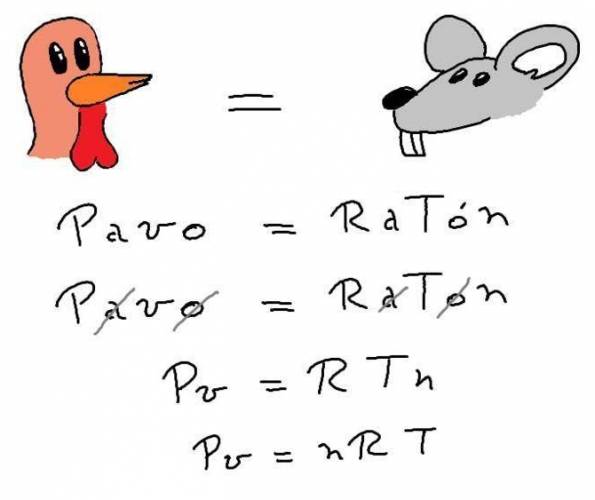|
Leyes de los gases
|
|
Leyes de los gases
Las leyes del estado gaseoso son un conjunto de leyes que intentan describir el comportamiento de los gases ideales. Cuando se intenta hacer una teoría sobre un hecho, se intenta idealizar en cierta medida, esto quiere decir que las siguientes leyes no describen el comportamiento de los gases a altas temperaturas o bajas presiones.
Constante de Regnault:
Partimos de la fórmula general de los gases:
Siempre partimos de condiciones normales.
1. Para cuando la presión nos es dada en torr:
Si partimos de que:
P = 760 torr
T = 273 K
n = 1,0 mol
V = 22,4 L
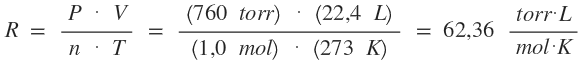
2. Para cuando la presión nos es dada en atm:
Si partimos de que:
P = 1,0 atm
T = 273 K
n = 1,0 mol
V = 22,4 L
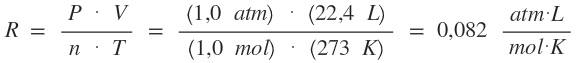
|
Ley de Dalton
Enunciado:
"La presión total ejercida por una mezcla gaseosa es igual a la suma de las presiones parciales de todos los gases que componen la mezcla."
Concepto de presión parcial de un gas: es la presión que cada gas componente de una mezcla gaseosa, ejerce independientemente de los demás gases (como si cada gas ocupara, en soledad, el volumen total del recipiente que contiene la mezcla). Esto se debe a que los átomos son muy pequeños y el espacio de separación entre ellos es muy grande, por lo que la probabilidad de que choquen es muy pequeña, prácticamente insignificante.
Fórmulas:
· Para calcular la presión total:
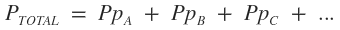

· Para calcular la presión parcial:


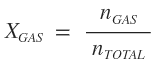
|
Ley de Avogadro
Enunciado:
"Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de particulas."
Expresión matemática de la ley:
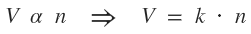
De esta ley se deduce el concepto de volumen molar de un gas: "un mol de moléculas de cualquier gas considerado en condiciones normales (P=1,0 atm ó 760 torr y T=273K ó 0ºC) ocupa un volumen de 22,4L".
|
Ley general
Una forma más fácil de recordarlo:
PAVO = RATÓN
Se tachan las vocales y queda:
P·V = R·T·N
|
Ley de Boyle o "de las isotermas":
Enunciado:
"El volumen de una masa de gas, a temperatura constante, es inversamente proporcional a la presión que soporta."
Por lo tanto:
$$ V \alpha \frac {1}{P} ∨ P·V = k $$
Esta ecuación corresponde a una hipérbola equilátera.
Para dos estados de una cierta masa de un gas dado, a temperatura constante:
$$ P_{1}·V_{1} = P_{2}·V_{2} $$
|
Ley de Charles o "de las isobaras":
Enunciado:
"Para una cierta masa de gas a presión constate, el volumen ocupado es directamente proporcional a la temperatura absoluta que soporta."
En realidad J. Charles efectuó el primer estudio experimental de la variación isobárica (presión constante), trabajando con la temperatura centígrada, descubriendo que por cada aumento de una grado en la temperatura, el volumen del gas se incrementa aproximadamente \( \frac {1}{273} \) de su valor a 0ºC. Éste es un valor fijo para todos los gases, denominado coeficiente de dilatación cúbica de un gas.
Trabajando a temperaturas absolutas, tenemos que: \( V \alpha T \). Si consideramos dos estados diferentes para una misma masa de un gas dado a presión constante:
$$ \frac {V_{1}}{V_{2}} =\frac {T_{1}}{T_{2}} $$
|