02-02-2013, 5:53 PM
El agua es un compuesto químico formado por hidrógeno y oxígeno, más concretamente, su fórmula química es H2O.
El agua a temperatura ambiente (20ºC) está en estado líquido, mientras que su temperatura de ebullición es de 100ºC y de fusión es de 0ºC.
Su densidad es de 1,0 g/cm3, o sea que el agua masa un gramo por cada centímetro cúbico que ocupa en el espacio.
Tipo de enlace:
El agua posee dos tipos de enlaces químicos: uno intramolecular (dentro de las moléculas) y otro intermolecular (entre moléculas).
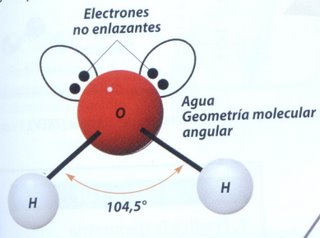
Una molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno. El enlace que mantiene estos átomos unidos (enlace intramolecular) es el enlace covalente polar. Mientras que la moléculas de agua están unidas (enlace intermolecular) por puentes de hidrógeno.
La molécula de agua:
El agua es un compuesto polar, esto quiere decir que tienes polos o zonas donde la molécula es más negativa y otras donde es más positiva.
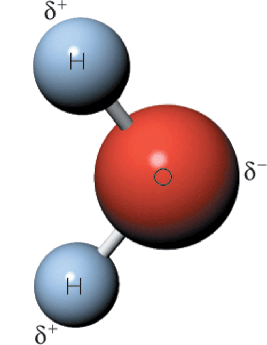
El O (oxígeno) es muy electronegativo (EO = 3,44), y decimos que tiene δ- (densidad de carga negativa) en la molécula de agua, mientras que el H (hidrógeno) es poco electronegativo (EH = 2,20), y decimos que tiene δ+ (densidad de carga positiva) en la molécula de agua.
Gracias a esto, es posible que se forma el puente de hidrógeno, ya que sólo se da entre el H (hidrógeno) y compuesto muy electronegativos. Se conoce con el nombre de puente de hidrógeno, ya que forma "puentes", o sea, el H (hidrógeno) une dos elementos iguales, en este caso O-H-O.
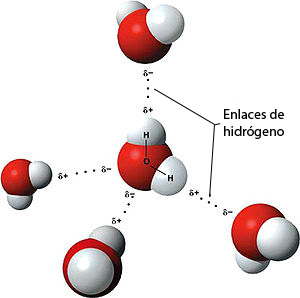
El ángulo que se forma entre los dos H (hidrógenos) de la molécula es de 104,5º.
"Tipos" de agua:
En realidad el compuesto químico agua, es único, o sea, H2O es agua pura, el H2O2 (agua oxigenada) no es agua, por lo que su nombre mundano es erróneo, su nombre químico es peróxido de hidrógeno.
Hay varios compuestos que son agua pero tienen mezclados otros compuestos o elementos químicos.
· Agua pura: H2O, la que venimos hablando desde el principio.
· Agua potable: es aquella que tiene vitaminas y minerales que son necesarias para nuestro cuerpo, por lo que podemos (y debemos) tomarla.
· Agua dura: es aquella agua que cuenta con exceso de iones de magnesio (Mg2+) y calcio (Ca2+).
· Agua pesada: es la que se usa en los reactores nucleares.
El agua pesada es un verdadero dolor de cabeza para todos aquellos que lavan con jabón, pues al reaccionar el jabón con los excesos de estas sales, resultan grumos que terminan manchando e incluso pegándose en la ropa, en este caso decimos que el agua dura corta al jabón.
Luego se descubrió el detergente, y se comprobó que esto no pasaba, al ser un compuesto cerrado. Entonces podemos afirmar que el detergente no se corta en agua dura.
El agua como disolvente:
El agua es un disolvente universal, esto no quiere decir que disuelva cualquier compuesto, sino que es capaz de disolver muchísimos compuestos.
Es muy común dentro del ámbito de la química, la frase: "similar disuelve a similar". Esto quiere decir que el agua es capaz de disolver compuestos polares y hasta iónicos, como es el caso de las sales y los hidróxidos.
Algunos ejemplos en química inorgánica:
· Hidrólisis del hidróxido de sodio:
$$ NaOH_{(ac)} ⇌ Na^{+}_{(ac)} + OH^{-}_{(ac)} $$
· Hidrólisis del ácido nítrico:
$$ HNO_{3 (ac)} ⇌ H^{+}_{(ac)} + NO_{3 (ac)}^{-} $$
· Hidrólisis del fostato de sodio (sal):
$$ Na_{3}PO_{4 (ac)} ⇌ 3Na^{+}_{(ac)} + PO_{4 (ac)}^{-3} $$
Dato importante sobre la hidrólisis: no estamos planteando una reacción de un compuesto con agua, sino que decimos que el compuesto está en medio acuoso y esto lo representamos poniendo al final de la fórmula química del compuesto: "(ac)". Si hubieras planteado una reacción química de un compuesto con agua, podría dar un tercer compuesto. La hidrólisis lo que hace es disociar al compuesto.
El agua a temperatura ambiente (20ºC) está en estado líquido, mientras que su temperatura de ebullición es de 100ºC y de fusión es de 0ºC.
Su densidad es de 1,0 g/cm3, o sea que el agua masa un gramo por cada centímetro cúbico que ocupa en el espacio.
Tipo de enlace:
El agua posee dos tipos de enlaces químicos: uno intramolecular (dentro de las moléculas) y otro intermolecular (entre moléculas).
Una molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno. El enlace que mantiene estos átomos unidos (enlace intramolecular) es el enlace covalente polar. Mientras que la moléculas de agua están unidas (enlace intermolecular) por puentes de hidrógeno.
La molécula de agua:
El agua es un compuesto polar, esto quiere decir que tienes polos o zonas donde la molécula es más negativa y otras donde es más positiva.

El O (oxígeno) es muy electronegativo (EO = 3,44), y decimos que tiene δ- (densidad de carga negativa) en la molécula de agua, mientras que el H (hidrógeno) es poco electronegativo (EH = 2,20), y decimos que tiene δ+ (densidad de carga positiva) en la molécula de agua.
Gracias a esto, es posible que se forma el puente de hidrógeno, ya que sólo se da entre el H (hidrógeno) y compuesto muy electronegativos. Se conoce con el nombre de puente de hidrógeno, ya que forma "puentes", o sea, el H (hidrógeno) une dos elementos iguales, en este caso O-H-O.

El ángulo que se forma entre los dos H (hidrógenos) de la molécula es de 104,5º.

"Tipos" de agua:
En realidad el compuesto químico agua, es único, o sea, H2O es agua pura, el H2O2 (agua oxigenada) no es agua, por lo que su nombre mundano es erróneo, su nombre químico es peróxido de hidrógeno.
Hay varios compuestos que son agua pero tienen mezclados otros compuestos o elementos químicos.
· Agua pura: H2O, la que venimos hablando desde el principio.
· Agua potable: es aquella que tiene vitaminas y minerales que son necesarias para nuestro cuerpo, por lo que podemos (y debemos) tomarla.
· Agua dura: es aquella agua que cuenta con exceso de iones de magnesio (Mg2+) y calcio (Ca2+).
· Agua pesada: es la que se usa en los reactores nucleares.
El agua pesada es un verdadero dolor de cabeza para todos aquellos que lavan con jabón, pues al reaccionar el jabón con los excesos de estas sales, resultan grumos que terminan manchando e incluso pegándose en la ropa, en este caso decimos que el agua dura corta al jabón.
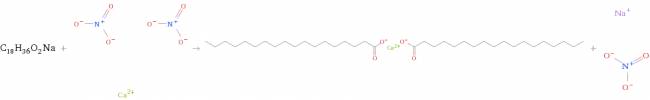
Supongamos la siguiente reacción química:
El estearato de sodio es un tipo de jabón duro. Si lo ponemos a reaccionar en aguas duras (aguas con exceso de calcio, como puede ser la sal nitrato de calcio) produce el diestearato de calcio que es insoluble, esto quiere decir no sólo "anula" el poder de limpieza del jabón, sino que también lo transforma en algo insoluble e inútil que se pega en la ropa.
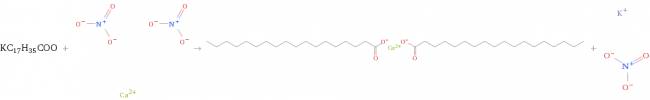
Se puede pensar análogamente para un jabón blando:
El estearato de sodio es un tipo de jabón duro. Si lo ponemos a reaccionar en aguas duras (aguas con exceso de calcio, como puede ser la sal nitrato de calcio) produce el diestearato de calcio que es insoluble, esto quiere decir no sólo "anula" el poder de limpieza del jabón, sino que también lo transforma en algo insoluble e inútil que se pega en la ropa.
Se puede pensar análogamente para un jabón blando:
Luego se descubrió el detergente, y se comprobó que esto no pasaba, al ser un compuesto cerrado. Entonces podemos afirmar que el detergente no se corta en agua dura.
El agua como disolvente:
El agua es un disolvente universal, esto no quiere decir que disuelva cualquier compuesto, sino que es capaz de disolver muchísimos compuestos.
Es muy común dentro del ámbito de la química, la frase: "similar disuelve a similar". Esto quiere decir que el agua es capaz de disolver compuestos polares y hasta iónicos, como es el caso de las sales y los hidróxidos.
Algunos ejemplos en química inorgánica:
· Hidrólisis del hidróxido de sodio:
$$ NaOH_{(ac)} ⇌ Na^{+}_{(ac)} + OH^{-}_{(ac)} $$
hidróxido de sodio ⇌ catión sodio + anión hidroxilo
· Hidrólisis del ácido nítrico:
$$ HNO_{3 (ac)} ⇌ H^{+}_{(ac)} + NO_{3 (ac)}^{-} $$
ácido nítrico ⇌ catión hidrógeno + anión nitrato
· Hidrólisis del fostato de sodio (sal):
$$ Na_{3}PO_{4 (ac)} ⇌ 3Na^{+}_{(ac)} + PO_{4 (ac)}^{-3} $$
fosfato de sodio ⇌ catión sodio + anión fosfato
Dato importante sobre la hidrólisis: no estamos planteando una reacción de un compuesto con agua, sino que decimos que el compuesto está en medio acuoso y esto lo representamos poniendo al final de la fórmula química del compuesto: "(ac)". Si hubieras planteado una reacción química de un compuesto con agua, podría dar un tercer compuesto. La hidrólisis lo que hace es disociar al compuesto.