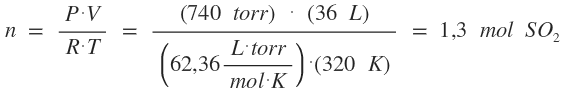20-09-2012, 2:09 PM
200 g de FeS comercial se hacen arder totalmente, recogiéndose 36 L de SO2 a 47ºC y 740 torr.
a. Calcule el porcentaje de pureza en masa del FeS.
b. Si todo el SO2 se disuelve en agua para formar 600 mL de solución: ¿cuál será la molaridad de la solución ácida resultante?
Quote
FeS + O2 --> SO2 + Fe
Quote
SO2 + H2O --> H2SO3
a. Calcule el porcentaje de pureza en masa del FeS.
b. Si todo el SO2 se disuelve en agua para formar 600 mL de solución: ¿cuál será la molaridad de la solución ácida resultante?